Nuove prospettive farmacologiche nella gestione delle obesità...
Il farmaco setmelanotide, ripristinando il segnale nel pathway...
L’obesità è una malattia cronica complessa, causata dall’interazione tra fattori genetici e ambientali, che rappresenta un importante problema sanitario sia nei paesi sviluppati che in quelli in via di sviluppo. L’incidenza dell’obesità infantile è in crescita e contribuisce significativamente alla mortalità aumentando il rischio di diabete, malattie cardiovascolari e altre comorbilità. Studi di associazione genome-wide e il sequenziamento di nuova generazione hanno portato a significativi progressi nella comprensione del contributo genetico all'obesità (1).
Le obesità genetiche e il ruolo del pathway leptina-melanocortina
Le obesità genetiche possono essere suddivise in due categorie:
- monogeniche, causate da mutazioni in geni come LEP, LEPR, POMC, PCSK1 e MC4R, che compromettono il pathway leptina-melanocortina, causando obesità precoce severa associata ad iperfagia, spesso accompagnata da disturbi endocrini.
- sindromiche, che includono anomalie genetiche più ampie e sono associate a disabilità intellettiva, dismorfismi e ritardo nello sviluppo. Tra le sindromi più comuni figurano la sindrome di Prader-Willi, la sindrome di Bardet-Biedl e quella di Alström.
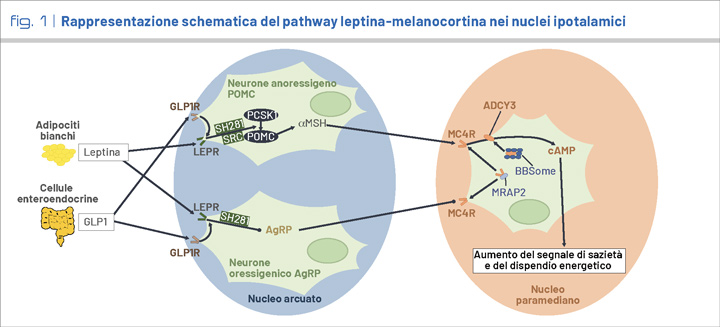
Le basi genetiche dell’obesità sono principalmente legate a disfunzioni del pathway leptina-melanocortina nei nuclei arcuato e paramediano dell’ipotalamo, essenziale nella regolazione del segnale di sazietà e del dispendio energetico (Fig. 1). L'ormone leptina, sintetizzato dal gene LEP negli adipociti, attiva il suo recettore (LEPR) inducendo, nei neuroni anoressigenici, l'attività della proprotein convertase subtilisin/kexin 1 (PCSK1), che converte la pro-opiomelanocortina (POMC) in a-MSH (ormone melanotropo a). Quest'ultimo è il ligando naturale del recettore melanocortinico di tipo 4 (MC4R), la cui attivazione comporta aumento del senso di sazietà e del dispendio energetico. Alterazioni in questo pathway possono essere causa di obesità. La comprensione di questi meccanismi ha permesso lo sviluppo di terapie innovative mirate. Di recente, l’introduzione di setmelanotide ha aperto nuove prospettive per il trattamento di specifiche obesità genetiche (2).
Setmelanotide: meccanismo d'azione, indicazioni e posologia
MC4R è un recettore associato alla proteina G che svolge un ruolo chiave nella regolazione dell'appetito, del bilancio energetico e del peso corporeo. Mutazioni del gene MC4R riducono la capacità del recettore di rispondere ai segnali anoressigeni, portando ad iperfagia e alterazioni del rapporto tra massa grassa e massa magra.
Setmelanotide, agonista selettivo del recettore MC4R, agisce ripristinando il segnale nel pathway leptina-melanocortina e ha dimostrato efficacia nei pazienti con deficit genetici di POMC, PCSK1 e LEPR, comportando riduzione dell’appetito e significativa perdita di peso, con un profilo di sicurezza adeguato (2). Nei pazienti con deficit di POMC, ad esempio, si è osservata una riduzione media del peso superiore al 10% entro 12 mesi. Tuttavia, l’efficacia è strettamente correlata alla continuità della terapia: l’interruzione determina un rapido ritorno dei sintomi.
Setmelanotide è stato approvato da FDA nel 2020 e da EMA nel 2021. In Italia entrambe le indicazioni seguenti hanno ottenuto il requisito di innovatività:
- trattamento dell’obesità e controllo della fame associati a sindrome di Bardet-Biedl geneticamente confermata nei pazienti di età ≥ a 6 anni
- trattamento dell’obesità e controllo della fame associati a deficit di POMC, compreso PCSK1, con perdita di funzione bi-allelica, o a deficit bi-allelico del recettore LEPR geneticamente confermati, nei pazienti di età ≥ a 6 anni (3).
Setmelanotide è inoltre prescrivibile ai sensi della legge 648/96 per l’indicazione “trattamento dell'obesità e controllo della fame associati all'obesità ipotalamica acquisita da craniofaringioma in pazienti con età > di 6 anni” (4).
La somministrazione avviene mediante iniezione sottocutanea una volta al giorno con dosaggio variabile in base all’età, secondo schemi di aumento graduale del dosaggio. In Italia la prescrizione è sottoposta a registro di monitoraggio; è infatti fondamentale una valutazione specialistica costante della risposta clinica e degli effetti collaterali.
Tra gli eventi avversi più comuni si annoverano reazioni nel sito d’iniezione, iperpigmentazione cutanea dovuta all’attività agonista di setmelanotide sul recettore della melanocortina 1 (MC1R) espresso sui melanociti, nausea, vomito e cefalea.
Durante il trattamento si raccomandano visite dermatologiche periodiche, monitoraggio semestrale di frequenza cardiaca e pressione sanguigna e valutazione di eventuale comparsa di patologia psichiatrica (depressione) (5).
Conclusioni
L'introduzione di trattamenti farmacologici mirati ha aperto nuove possibilità nella gestione delle obesità genetiche, trasformando l’approccio terapeutico per queste patologie rare e invalidanti.
La diagnosi genetica precoce è fondamentale per poter accedere alle terapie personalizzate, così da permettere un significativo miglioramento della qualità di vita dei pazienti.
Bibliografia
- Littleton SH, Berkowitz RI, Grant SFA. Genetic Determinants of Childhood Obesity. Mol Diagn Ther. 2020; 24(6): 653–663.
- Faccioli N, Poitou C, Clément K, Dubern B. Current Treatments for Patients with Genetic Obesity. J Clin Res Pediatr Endocrinol. 2023;15(2):108-119.
- https://www.aifa.gov.it/farmaci-innovativi - Elenco farmaci innovativi - 30/11/2024
- https://www.aifa.gov.it/legge-648-96 - Lista farmaci 648/96 aggiornato al 18/11/2024
- Imcivree, Riassunto delle Caratteristiche del Prodotto.





