Obesità genetiche: quando e perché sospettarle | Alcune...
Alcune obesità infantili sono dovute a forme genetiche...
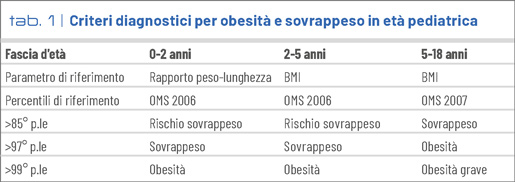 L’obesità è una patologia cronica associata ad incrementata morbidità e mortalità. Rappresenta la principale endemia pediatrica del secolo, con una prevalenza che è aumentata esponenzialmente a livello globale, passando dall'8% nel 1990 al 20% nel 2022 nella fascia di età 5-19 anni (1). In età pediatrica la diagnosi di obesità si basa su specifiche curve di riferimento per età e sesso (Tab. 1).
L’obesità è una patologia cronica associata ad incrementata morbidità e mortalità. Rappresenta la principale endemia pediatrica del secolo, con una prevalenza che è aumentata esponenzialmente a livello globale, passando dall'8% nel 1990 al 20% nel 2022 nella fascia di età 5-19 anni (1). In età pediatrica la diagnosi di obesità si basa su specifiche curve di riferimento per età e sesso (Tab. 1).
L'obesità deriva da una complessa interazione tra fattori genetici, epigenetici, ambientali e comportamentali che determinano uno squilibrio tra intake calorico e spesa energetica.
Le cause ambientali hanno un ruolo centrale nell’obesità cosiddetta essenziale (o primaria). Esiste tuttavia una componente genetica alla base della variabilità interindividuale del peso corporeo: i fattori genetici possono contribuire fino al 25% nel predisporre all'obesità (2). La crescente identificazione di varianti genetiche suggerisce che l'obesità dovrebbe essere definita "poligenica", non solo "essenziale".
A differenza della forma poligenica, esistono rare forme di obesità "genetiche” che si caratterizzano per l’elevata penetranza del singolo difetto genetico e la scarsa/assente influenza dei fattori ambientali. Queste forme presentano un rischio maggiore di complicanze e una prognosi peggiore: infatti, i rischi di comorbidità legate all'obesità aumentano con l'insorgenza precoce e la maggiore gravità dell'obesità e sono quindi maggiori nelle obesità genetiche (2).
Omeostasi del peso corporeo
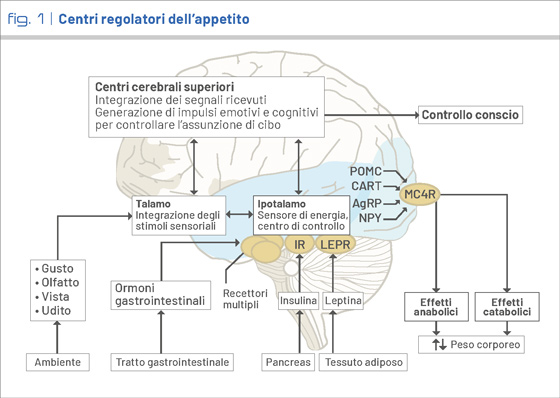
Il controllo dell’appetito è regolato da circuiti neuroendocrini che coinvolgono il tessuto adiposo, il tratto gastrointestinale (GI) e il sistema nervoso centrale. I principali sistemi regolatori sono (Fig. 1):
- Il sistema omeostatico è principalmente regolato dall’ipotalamo e dal tronco encefalico. A livello ipotalamico sono coinvolti due tipi di neuroni: quelli che producono neuropeptide Y (NPY) e peptide agouti-correlato (AgRP), e quelli che producono proopiomelanocortina (POMC).
La leptina, un ormone secreto dalle cellule adipose, regola questi neuroni tramite dei recettori specifici: alti livelli di leptina inducono il senso di sazietà, inibendo la produzione di NPY e AgRP; viceversa, bassi livelli di leptina ne stimolano la produzione, incrementando il senso di fame (3). La leptina stimola anche la produzione di POMC, che, attiva i recettori della melanocortina 4 (MC4R) inducendo sazietà. L'equilibrio tra questi segnali determina il comportamento alimentare, interagendo con segnali a lungo termine prodotti dalla massa grassa e segnali a breve termine prodotti dal sistema GI (3). - Il sistema non omeostatico è regolato da centri cerebrali a livello superiore. Dopo l'integrazione nel talamo, i segnali omeostatici si combinano con gli stimoli sensoriali (vista, olfatto e gusto) e con le esperienze; gli impulsi emotivi e cognitivi generati regolano quindi l'assunzione di cibo (3).
Quando questi circuiti regolatori sono alterati, lo squilibrio tra intake calorico e spesa energetica conduce a obesità.
Classificazione delle obesità genetiche
Storicamente le obesità genetiche sono state classificate in:
- Obesità sindromiche, caratterizzate da un fenotipo clinico complesso in cui all'obesità si associano altre manifestazioni cliniche quali ritardo dello sviluppo neuromotorio e malformazioni organo-specifiche (2). Sono dovute a mutazioni in singoli geni o delezioni/difetti dell’imprinting in specifiche regioni cromosomiche.
- Obesità monogeniche, caratterizzate dal punto di vista fenotipico quasi unicamente dalla grave obesità, sono forme causate da una mutazione di un singolo gene all'interno della via MC4R (2).
Va sottolineato come tale classificazione sia unicamente fenotipica (presenza o meno di ritardo neuromotorio e/o di malformazioni d’organo) e non abbia una correlazione eziopatogenetica; infatti è ormai noto che alcune forme di obesità sindromica siano dovute alla mutazione di un singolo gene afferente alla via MC4R (come nel caso della sindrome di Bardet-Biedl, e della sindrome di Alström) (2).
Obesità sindromiche
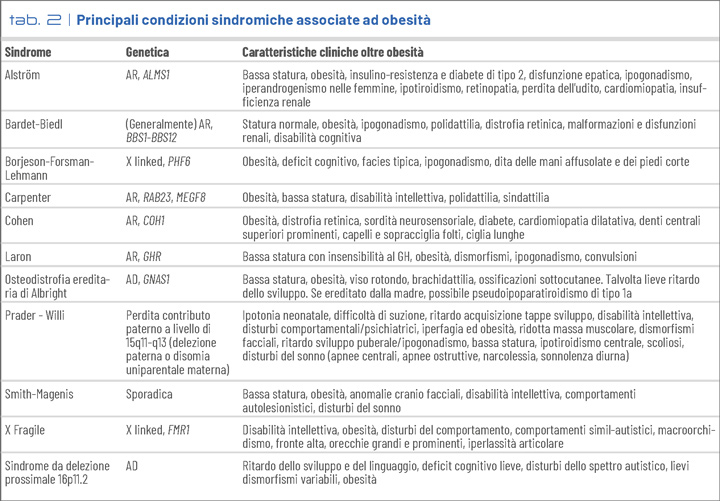
Sono state descritte oltre 80 diverse sindromi che si associano ad obesità (Tab. 2); la più comune è la sindrome di Prader-Willi (PWS) (2).
La PWS, causata da un difetto dell’imprinting della regione cromosomica 15q11-13, si caratterizza per diverse fasi nutrizionali (4): ipotonia muscolare e difficoltà di suzione con scarso accrescimento nel periodo neonatale e nella prima infanzia; a partire dai 2-4 anni rallentamento del metabolismo basale, iperfagia e conseguente obesità severa. Possono essere presenti altre manifestazioni di tipo ormonale, cognitivo-comportamentale, ortopediche e disturbi del sonno. Tuttavia, la morbilità e la mortalità della PWS sono principalmente dovute alle complicanze dell’obesità grave. Ad oggi la storia naturale della PWS è cambiata grazie al percorso multidisciplinare di educazione familiare che consente la precoce modifica dello stile di vita (4). Pertanto, in caso di ipotono neonatale è indispensabile effettuare un test di metilazione per la diagnosi genetica al fine di indirizzare i pazienti ad un centro di III livello per la presa in carico (4) e l’avvio della terapia con somministrazione dell’ormone della crescita (GH) entro l’anno di vita.
Obesità monogeniche
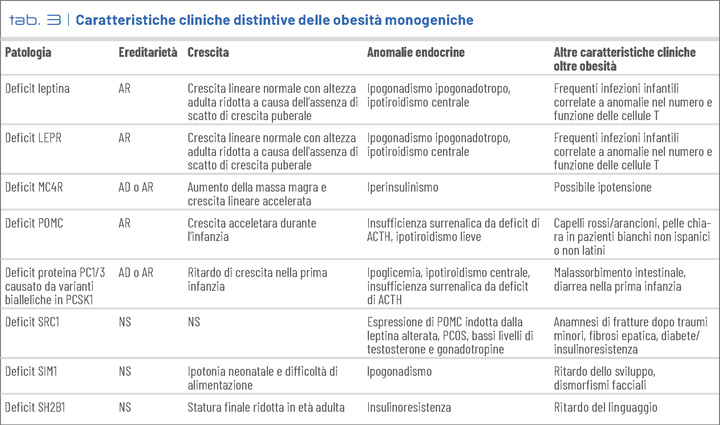
Le obesità monogeniche presentano obesità grave ad esordio precoce associata ad iperfagia (2). Non sono presenti generalmente ritardo neuromotorio né malformazioni d’organo. Tuttavia, le singole mutazioni geniche si associano a manifestazioni specifiche (Tab. 3), tra cui difetti ormonali ipotalamici (come in alcune forme sindromiche di obesità) (2).
Quando sospettare una forma di obesità genetica
 Le linee guida raccomandano test genetici nei bambini con obesità grave (BMI ≥120% del 95° percentile) ad esordio precoce, iperfagia e/o una storia familiare di obesità grave (5).
Le linee guida raccomandano test genetici nei bambini con obesità grave (BMI ≥120% del 95° percentile) ad esordio precoce, iperfagia e/o una storia familiare di obesità grave (5).
Per esordio precoce si intende prima dei 5 anni di età (2) in quanto l’obesità essenziale tipicamente insorge dopo i 6-7 anni (6).
L’iperfagia è definita come fame continua e insaziabile che può sfociare in un comportamento ossessivo di ricerca di cibo (Tab. 4) (7). L’iperfagia è difficile da oggettivare, anche se si sta diffondendo l’utilizzo di specifici questionari come quello proposto da Dykens (7).
La presenza di familiarità è un elemento discordante tra le differenti pubblicazioni. Nelle forme ad ereditarietà autosomica dominante (AD) è presente obesità severa in uno dei genitori; tuttavia, l’eccesso ponderale in entrambi i genitori è spesso presente nei casi di obesità poligenica come fattore ambientale favorente. La presenza di genitori normopeso potrebbe quindi porre il sospetto di una forma autosomica recessiva (AR) o dominante de novo.
Ulteriori red flags sono quei sintomi associati alle forme monogeniche o sindromiche (Tab. 5) (2). La presenza di grave ritardo cognitivo e/o disturbo dello spettro autistico (ASD) come unica manifestazione associata all’obesità può esser fuorviante: spesso le forme più gravi di ASD sfociano in grave obesità, secondaria al mancato controllo del disturbo comportamentale e non ad iperfagia. La diagnosi differenziale è spesso difficile (8).
Algoritmo diagnostico
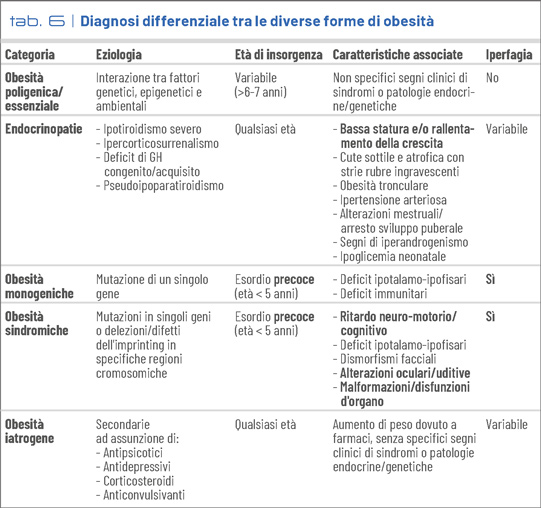
Il sospetto clinico di obesità genetica si basa su un’accurata valutazione anamnestica, antropometrica e clinica, escludendo forme secondarie (Tab. 6).
Dovrebbe essere condotta un’attenta anamnesi familiare, ricercando la presenza di consanguineità genitoriale, storia di obesità severa o interventi di chirurgia bariatrica in famiglia (1).
È necessario ricercare la presenza di problematiche durante il periodo neonatale, valutare lo sviluppo neuromotorio e la presenza di problemi comportamentali.
È fondamentale valutare le curve di crescita del paziente: la curva del peso permette di stabilire l’età di insorgenza dell’obesità, quella dell’altezza la presenza di un arresto di crescita staturale e/o bassa statura. Va valutata l’esecuzione di eventuali esami ormonali (assi ipofisari, bilancio calcio fosforo), strumentali e visite specialistiche (visita oculistica con elettroretinogramma, visita neuropsichiatrica con quoziente di sviluppo e visita otorinolaringoiatrica con audiogramma) (9).
Una volta posto il sospetto di obesità genetica, le indagini successive sono guidate dalle manifestazioni aggiuntive identificate, come indicato dall’algoritmo proposto da Mainieri et al. (Fig. 2) (2).

Trattamento
L’obesità genetica rappresenta un importante problema di gestione quotidiana. L’iperfagia peggiora in modo significativo la qualità di vita del paziente e della famiglia che deve continuamente supervisionarlo; a questa spesso si aggiungono manifestazioni invalidanti quali ritardo cognitivo, disturbi comportamentali e cecità.
Ricevere la conferma di una diagnosi genetica aiuta le famiglie a gestire il carico psicologico della patologia. Inoltre, la diagnosi precoce consente la presa in carico multidisciplinare in centri di III livello.
Ad oggi il gold standard nel trattamento delle obesità genetiche restano le indicazioni dietetico-comportamentali, spesso estremamente restrittive e poco efficaci se introdotte quando il paziente ha già sviluppato un suo stile di vita. Una presa in carico precoce e uno stile di vita adeguato sin dalla nascita può modificare la storia naturale della patologia. Esempio ne è la PWS: studi evidenziano come un’adeguata educazione familiare effettuata sin dalla nascita del piccolo permettono di prevenire l’insorgenza di obesità o almeno di ritardarla di diversi anni (4).
Recentemente i progressi compiuti in ambito genetico hanno aperto la strada a trattamenti farmacologici innovativi per diverse forme di obesità genetica, mirati agli specifici meccanismi patogenetici alterati. Per esempio è stata recentemente approvata dall’AIFA la terapia con setmelanotide (agonista selettivo del recettore MC4R) per quelle forme di obesità monogenica secondarie ad un’alterazione nel pathway del MC4R, tra cui il deficit di LEPR, PCSK1, POMC3 e la BBS. Questo farmaco è efficace nel trattare l’iperfagia dovuta ad un’alterazione a monte del recettore MC4R (10). Nei pazienti senza difetti genetici nel pathway MC4R, setmelanotide non ha effetto sul peso né sull’iperfagia.
Conclusioni
Una piccola percentuale delle obesità infantili è attribuibile a forme genetiche, tipicamente caratterizzate da iperfagia e ridotta spesa energetica. Le attuali conoscenze sui meccanismi genetici associati all'obesità si stanno rapidamente espandendo. I test genetici sono raccomandati per i bambini che presentano obesità estrema e precoce con iperfagia. La diagnosi precoce di obesità genetica garantisce un intervento tempestivo in termini di gestione terapeutica e prevenzione dello sviluppo di condizioni metaboliche associate.
Bibliografia
- Valerio G, Saggese G, Maffeis C, et al. Diagnosi, trattamento e prevenzione dell’obesità del bambino e dell’adolescente. Consensus della Società Italiana di Pediatria e della Società Italiana di Endocrinologia e Diabetologia pediatrica, 2017.
- Fitch AK, Malhotra S, Conroy R. Differentiating monogenic and syndromic obesities from polygenic obesity: Assessment, diagnosis, and management. Obes Pillars. 2024;11:100110.
- Lister NB, Baur LA, Felix JF, et al. Child and adolescent obesity. Nat Rev Dis Primers. 2023;9(1):24.
- Butler MG, Miller JL, Forster JL. Prader-Willi Syndrome - Clinical Genetics, Diagnosis and Treatment Approaches: An Update. Curr Pediatr Rev. 2019;15(4):207-244.
- Styne DM, Arslanian SA, Connor EL, et al. Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017;102(3):709-757.
- Wrzosek M, Wiśniewska K, Sawicka A, et al. Early Onset of Obesity and Adult Onset of Obesity as Factors Affecting Patient Characteristics Prior to Bariatric Surgery. Obes Surg. 2018; 28, 3902–3909.
- Arnouk L, Chantereau H, Courbage S, et al. Hyperphagia and impulsivity: use of self-administered Dykens' and in-house impulsivity questionnaires to characterize eating behaviors in children with severe and early-onset obesity. Orphanet J Rare Dis. 2024;19(1):84.
- Curtin C, Jojic M, Bandini LG. Obesity in children with autism spectrum disorder. Harv Rev Psychiatry. 2014;22(2):93-103.
- Dollfus H, Lilien MR, Maffei P, et al. Bardet-Biedl syndrome improved diagnosis criteria and management: Inter European Reference Networks consensus statement and recommendations. Eur J Hum Genet. 2024; 32, 1347–1360.
- Clément K, van den Akker E, Argente J, et al. Efficacy and safety of setmelanotide, an MC4R agonist, in individuals with severe obesity due to LEPR or POMC deficiency: single-arm, open-label, multicentre, phase 3 trials. Lancet Diabetes Endocrinol. 2020;8(12):960-970.





