Pensa globale, agisci locale: la carenza di emoderivati e le...
La separazione delle diverse proteine contenute nel plasma...
Uso terapeutico del sangue
Quando si pensa all’uso terapeutico del sangue, l’attenzione corre agli articoli pubblicati dalla stampa ed agli appelli sui social in occasione di grandi catastrofi o attacchi terroristici per sopperire a supposte carenze di sangue per trattare i feriti. I dati del Centro Nazionale Sangue evidenziano però come il trattamento di un ferito grave per un incidente richieda al massimo 10 donatori. Gli interventi chirurgici che usano più sangue, come il trapianto di cuore e quello di fegato richiedono generalmente da 10 a 40 donatori (1). Le malattie rare, quali le forme trasfusione-dipendenti di talassemia e le sindromi mielodisplastiche, richiedono invece un numero di unità di globuli rossi che può raggiungere le 50/anno per paziente.
Sangue: non solo globuli rossi e piastrine
Oggi, però, la componente del sangue maggiormente utilizzata è il plasma, ovvero la parte liquida. La separazione delle diverse proteine contenute nel plasma deve rispettare le norme europee sui farmaci e permette di ottenere dei farmaci plasmaderivati (FPD) salvavita per i pazienti affetti da diverse malattie rare congenite ed acquisite.
Storicamente il primo FPD umano è stato l’albumina, purificata da Edwin Cohn mediante precipitazione in etanolo a cavallo della seconda guerra mondiale ed usata per trattare i soldati feriti in battaglia e i pazienti con shock emorragici (2).
Nel 1965 Judith Pool ha introdotto la crioprecipitazione del plasma permettendo il trattamento dell’emofilia A, una malattia emorragica rara dovuta al deficit del fattore VIII della coagulazione. Negli anni ’70 del secolo scorso il fattore VIII plasmatico era uno dei principali FPD prodotti a livello mondiale. Gli anni ’80, in seguito all’insorgenza delle epidemie di HIV e HCV che hanno provocato tantissime vittime proprio fra i pazienti emofilici, hanno visto l’introduzione dei fattori VIII ricombinanti. Oggi, nonostante il rischio di contrarre infezioni dai fattori VIII di origine plasmatica sia sostanzialmente assente, la maggior parte degli emofilici italiani vengono trattati con fattori VIII ricombinanti, o con farmaci di nuova concezione, quali emicizumab (3).
La precipitazione mediante etanolo permetteva anche di separare le immunoglobuline (Ig) utilizzabili per trattare pazienti affetti da deficit anticorpali congeniti e acquisiti; queste potevano però essere somministrate solo per via intramuscolare o sottocutanea in quanto il processo di produzione portava alla formazione di macroaggregati che provocavano importanti reazioni quando infusi endovena (EV). Il primo paziente affetto da agammaglobulinemia di Bruton, una severa forma di immunodeficienza congenita X linked associata a deficit di tutte le classi immunoglobuliniche, fu trattato da Janeway nel 1952 con Ig sottocute (3). Al fine di ottenere un mix di Ig efficaci per prevenire le infezioni nei pazienti affetti da immunodeficienze primitive o secondarie è necessario creare dei pool con il plasma proveniente da migliaia di donatori. Solo negli anni ’70 del secolo scorso si riuscirono a produrre delle Ig prive di macroaggregati somministrabili endovena.
Questo sviluppo, oltre a facilitare il trattamento dei pazienti affetti da immunodeficienze ha aperto la strada all’uso delle Ig a scopo immunomodulante (4). I primi dati aneddotici sull’efficacia delle Ig ad alte dosi per il trattamento delle anemie autoimmuni e della piastrinopenia idiopatica risalgono agli anni ’60. Successivamente gli studi si sono estesi a numerose patologie autoimmuni organo-specifiche e sistemiche, con una particolare indicazione nelle neuropatie disimmuni - quali la sindrome di Guillain-Barré, la polineuropatia cronica infiammatoria demielinizzante (CIDP) e la miastenia Gravis - e nelle vasculiti sistemiche. Oggi la posologia più utilizzata nel trattamento delle patologie disimmuni è 0,4 g/kg/die di Ig EV per 5 giorni consecutivi; il dosaggio sostituivo nelle immunodeficienze è variabile ma generalmente minore (3). Oggi le Ig EV e sottocutanee (reintrodotte negli ultimi decenni in quanto somministrabili anche a domicilio) sono il FPD maggiormente usato. Nel corso degli anni sono stati prodotti FPD per la cura di numerose altre malattie rare quali i disturbi emorragici da carenza congenita di varie proteine plasmatiche della coagulazione, l’angioedema ereditario da deficit di C1 esterasi inibitore, e il deficit di alfa1 antitripsina (2).
La carenza di plasma e di plasmaderivati
La produzione dei FPD richiede un numero importante di donatori. Ad esempio, il trattamento annuale di un paziente affetto da agammaglobulinemia richiede il plasma raccolto da almeno 130 donatori (1). Il plasma può essere ottenuto o dalla lavorazione del sangue intero o con metodiche di plasmaferesi (5). Numerosi FPD, fra cui le Ig e i fattori VIII e IX della coagulazione sono classificati dall’OMS come farmaci essenziali (5). In Italia il plasma ottenuto dalla donazione di sangue intero o mediante plasmaferesi è aumentato nel tempo passando dai 462.805 chilogrammi nel 2000 agli 858.900 chilogrammi nel 2019 (6). Questa quantità di plasma non permette tuttavia di raggiungere l’autosufficienza, ovvero di coprire il fabbisogno necessario per la cura di tutti i pazienti italiani. I dati dell’ultimo rapporto del Centro Nazionale Sangue, relativi al 2019, evidenziano una copertura che va dal 100% per il fattore VIII (tenendo però conto che la maggior parte dei pazienti viene trattata con farmaci ricombinanti) al 6% per le Ig ad uso sottocutaneo. Le Ig hanno una copertura pari al 79% del richiesto (6).
Pensare globale
I FPD che non possono essere prodotti con il plasma dei donatori italiani devono essere importati dall’estero. Oggi il 35-40% dei FPD usati in Europa proviene da altre nazioni, principalmente dagli Stati Uniti, che rappresentano il principale produttore mondiale di plasma, ottenuto principalmente da donatori che vengono pagati (7). L’epidemia di COVID-19, che ha comportato una riduzione delle donazioni mondiali di plasma (-14.5% nel 2020 rispetto al 2019), una serie di politiche nazionali — quali l’America first introdotta dall’amministrazione Trump —, le scelte commerciali delle aziende farmaceutiche — negli ultimi anni si è assistito ad una riduzione dei produttori di FPD con un maggior rischio di attività di tipo monopolistico e si è avuto uno spostamento delle vendite verso mercati in grado di pagarli maggiormente, quali la Cina —, nonché la maggior capacità di diagnosticare patologie curabili con i FPD hanno reso drammaticamente evidente quanto anche nell’ambito dei FPD esista una strettissima interdipendenza globale (5).
Agire locale
Come evidenzia anche l’OMS, l’unica possibilità per cercare di far fronte alle problematiche della carenza di FPD e soprattutto di immunoglobuline è rappresentata da politiche sanitarie volte a garantire una autosufficienza nella produzione di FPD delle diverse nazioni, o per lo meno delle diverse macroaree geografiche (5). Già nel 2005 la legge n°. 219 - Nuova disciplina delle attività trasfusionali e della produzione nazionale degli emoderivati poneva l’autosufficienza del plasma e dei FPD fra gli obiettivi del Sistema Nazionale Sangue. Questo processo, pur dovendosi basare su attività di ricerca e politiche internazionali, non può che avvenire a livello di singole nazioni, regioni ed aziende sanitarie.
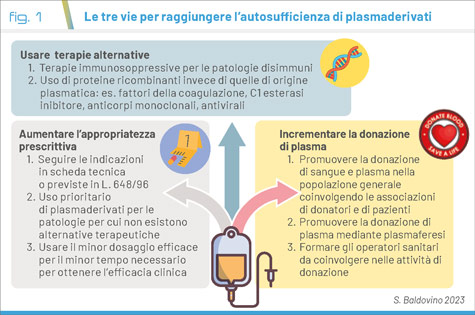 Le strade per raggiungere l’obiettivo dell’autosufficienza sono tre (Fig. 1):
Le strade per raggiungere l’obiettivo dell’autosufficienza sono tre (Fig. 1):
- Aumentare l’appropriatezza prescrittiva, soprattutto per quanto riguarda l’uso delle Ig a scopo immunomodulatorio in particolare in ambito neurologico, maggiormente implicato nel loro uso. Nel 2022 il Centro Nazionale Sangue ha redatto un documento di indirizzo in cui vengono delineati diversi livelli di carenza di Ig evidenziando che la prescrizione deve avvenire esclusivamente nel rispetto delle indicazioni autorizzate da scheda tecnica e di quelle ammesse alla rimborsabilità ai sensi della Legge 648/96, prevedendo l’utilizzo prioritario nelle indicazioni per le quali non sono disponibili alternative terapeutiche e l’uso preferenziale di alternative terapeutiche ove disponibili e l’uso del minor dosaggio efficace per il minor tempo necessario a garantire l’efficacia clinica (8). Da segnalare la proposta di alcuni schemi terapeutici con Ig EV a scopo immunomodulante che prevedono la somministrazione per 3 giorni invece che per i classici 5, consentendo il risparmio del 40% di Ig a parità di efficacia (9).
- Cercare terapie alternative. In numerose patologie autoimmuni è possibile ricorrere a terapie immunosoppressive e immunomodulanti alternative alle Ig. Inoltre gli avanzamenti della biologia molecolare permettono la produzione di proteine che possono sostituire quelle di derivazione plasmatica, quali il C1 esterasi inibitore o le Ig per il trattamento di specifiche infezioni (10).
- Aumentare la donazione di plasma. L’incremento della donazione di plasma è uno degli obiettivi intrapresi dal Centro Nazionale Sangue, in collaborazione con le associazioni e le federazioni di donatori (AVIS, CRI, FIDAS e FRATRES) ma anche dalle associazioni di pazienti coinvolte (Associazione Immunodeficienze Primitive - AIP, Associazione CIDP Italia, UNIAMO). La finalità di queste iniziative è quella di incrementare il numero di donatori di plasma attualmente nettamente al di sotto di quanto necessario. Oltre all’incremento di donatori è però anche indispensabile il coinvolgimento di un maggior numero di operatori sanitari che svolgano le attività di selezione dei donatori. Una prima iniziativa in tal senso è stata promossa dall’Università degli Studi di Torino e dalla Struttura Regionale di Coordinamento della rete Trasfusionale della Regione Piemonte con l'istituzione di un master per formare infermieri con specifiche competenze nell’ambito della selezione dei donatori e della raccolta di sangue e di plasma (11).
Bibliografia
- Sito Centro Nazionale Sangue https://www.centronazionalesangue.it/infografiche/ (visitato il 30/05/2023).
- Farrugia A, Cassar J. Plasma-derived medicines: access and usage issues. Blood Transfus. 2012;10(3):273-8.
- Eibl MM. History of immunoglobulin replacement. Immunol Allergy Clin North Am. 2008;28(4):737-64, viii.
- Emmi L, Chiarini F. The role of intravenous immunoglobulin therapy in autoimmune and inflammatory disorders. Neurol Sci. 2002;23 Suppl 1:S1-8.
- Strengers PFW. Challenges for Plasma-Derived Medicinal Products. Transfus Med Hemother. 2023;50(2):116-122.
- Candura F, Massari MS, Profili S, et al. Analisi della domanda di medicinali plasmaderivati in Italia 2019. Rapporti ISTISAN 21/13. 2021, vii, 138 p.
- Tiberghien P. Increasing unpaid plasma collection by blood establishments to ensure availability of plasma-derived medicinal products and blood components in Europe. Transfus Clin Biol. 2021;28(4):331-333.
- Documento di indirizzo sull’uso delle immunoglobuline umane in condizioni di carenza. https://www.aifa.gov.it/-/documento-indirizzo-aifa-cns-uso-immunoglobuline-umane-condizioni-carenza (visitato il 30/05/2023).
- Sciascia S, Giachino O, Roccatello D. Prevention of thrombosis relapse in antiphospholipid syndrome patients refractory to conventional therapy using intravenous immunoglobulin. Clin Exp Rheumatol. 2012;30(3):409-13.
- Garzi G, Cinetto F, Firinu D, et al. Real-life data on monoclonal antibodies and antiviral drugs in Italian inborn errors of immunity patients during COVID-19 pandemic. Front Immunol. 2022;13:947174.
- Sito del Master in Medicina Trasfusionale - Università di Torino https://www.corep.it/formazione/master-universitari/9-master-in-corso/162-medicina-trasfusionale22-23.html (visitato il 30/05/2023).





